Maddələrin təsnifatı
Maddələrin təsnifatı bir sıra əlamətlərə görə aparıla bilər.
1. Normal şəraitdə (0°C temperatur və 1 atm təzyiq şəraitində) aqreqat halına görə maddələr qaz, maye və bərk maddələrə bölünür.
Bərk halda olan maddələr: civədən (Hg) başqa bütün metallar (dəmir (Fe), mis (Cu), gümüş (Ag), qızıl (Au), sink (Zn) və s.), çay qumu (SiO2), xörək duzu (NaCl), şəkər, qələvilər (natrium-hidroksid (NaOH), kalium-hidroksid (KOH) və s).
2. Fiziki xassələrə görə maddələr iki yerə bölünür (saf maddələr və qarışıqlar). Sabit fiziki xassələrə (ərimə, qaynama temperaturuna, sıxlığa və s.) malik olmayan maddələr qarışıqlara aiddir (bax mövzu 1 və 2).
3. Mənşəyinə görə maddələr qeyri-üzvi və üzvi maddələrə bölünür. Karbonun birləşmələrindən dəm qazı (CO), karbon qazı (CO2), karbonat turşusu (H2CO3), onun bütün duzları, məsələn, soda (Na2CO3), çay sodası (NaHCO3), əhəngdaşı (CaCO3) qeyri-üzvi birləşmələrə aiddir. Tərkibində yalnız karbon ©, hidrogen (H) və ya tərkibində karbon, hidrogen, oksigen olan birləşmələr və s. üzvi birləşmələrə aiddir.
Məsələn, metan qazı (CH4), etilen (C2H4), etil spirti (C2H5OH), sirkə turşusu (CH3COOH) və s. üzvi birləşmələrə aiddir.
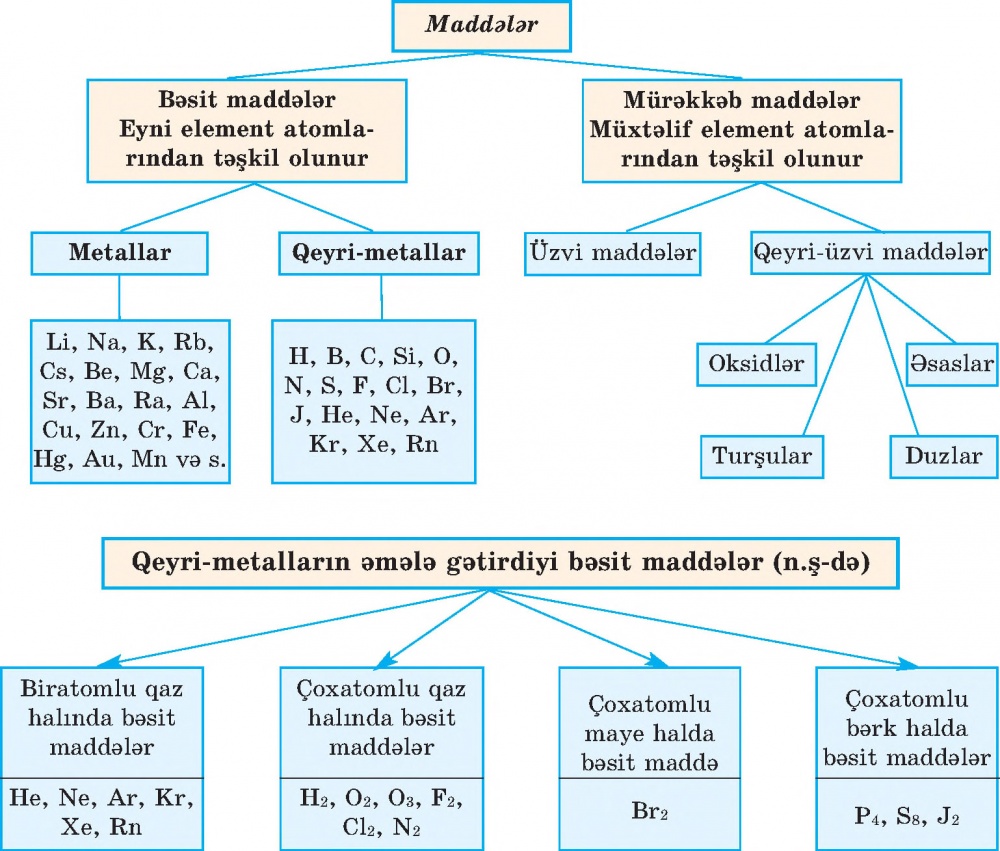
4. Tərkibinə görə maddələr iki yerə bölünür: bəsit və mürəkkəb maddələr.
Maddələrin tərkibi eyni və yaxud müxtəlif element atomlarından ibarət ola bilər.
Eyni növ atomlardan əmələ gəlmiş maddələr bəsit maddələr adlanır.
Müxtəlif növ atomlardan əmələ gəlmiş maddələrə mürəkkəb maddələr deyilir.
Sizin tanıdığınız dəmir, mis, alüminium, civə, qalay, qurğuşun, qızıl, gümüş, kükürd, fosfor, yod, hidrogen, oksigen, almaz, qrafit və s. bəsit maddələrdir. Onlar bərk halda həm molekulyar (kükürd, ağ fosfor, yod və s.), həm də qeyri-molekulyar (dəmir, mis, almaz, qrafit və s.) quruluşa malik olduğundan müxtəlif xassəlidir. Xassələrinə görə bəsit maddələri 2 qrupa bölürlər: metallar və qeyri-metallar. Metallar adi şəraitdə bərk (civədən başqa) halda olur, elektrik cərəyanını və istiliyi yaxşı keçirir, plastik xassəlidir—döyülüb yastılana bilir. Fe, Cu, Al, Pb, Sn, Ag, Au, Zn, Na, К və s. elementlərin əmələ gətirdiyi bəsit maddələr metal xassəlidir. Onların adları elementlərin adı ilə eynidir. Qeyri-metallar isə əksinə, istiliyi pis keçirir, elektriki isə əsasən, keçirmirlər, onlar adi şəraitdə qaz, maye və bərk halda olur. Adi şəraitdə bərk halda olan qeyri-metallar (almaz, qrafit, yod, kükürd, fosfor və s.) kövrək xassəlidir — döyüldükdə asanlıqla qırılır. O, H, N, P, Cl, Br, J və s. qeyri-metallar eyniadlı müxtəlif aqreqat halında olan bəsit maddələr əmələ gətirir.
Bəsit maddələr kimyəvi elementlərin sərbəst halda mövcudluq formasıdır.
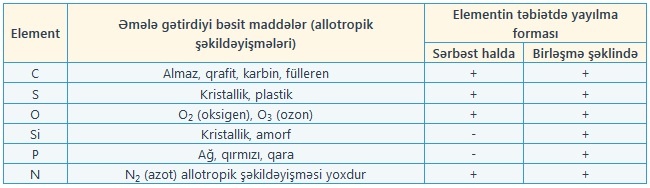
Eyni bir kimyəvi elementin bir neçə bəsit maddə əmələ gətirməsi hadisəsinə allotropiya, əmələ gəlmiş bəsit maddələrə isə həmin elementin allotropik şəkildəyişmələri deyilir.
1. Normal şəraitdə (0°C temperatur və 1 atm təzyiq şəraitində) aqreqat halına görə maddələr qaz, maye və bərk maddələrə bölünür.
Qaz halında olan maddələr: Hidrogen (H2), oksigen (O2), ozon (O3), flüor (F2), xlor (Cl2), azot (N2), metan (CH4), ammonyak (NH3), dəm qazı (CO), karbon qazı (CO2), etilen (C2H4), asetilen (C2H2) və s. qaz halındadır.
Maye halında olan maddələr: Nitrat turşusu (HNO3), su (H2O), sulfat turşusu (H2SO4), metil spirti (CH3OH), etil spirti (C2H5OH), brom (Br2), civə (Hg) və s.Bərk halda olan maddələr: civədən (Hg) başqa bütün metallar (dəmir (Fe), mis (Cu), gümüş (Ag), qızıl (Au), sink (Zn) və s.), çay qumu (SiO2), xörək duzu (NaCl), şəkər, qələvilər (natrium-hidroksid (NaOH), kalium-hidroksid (KOH) və s).
2. Fiziki xassələrə görə maddələr iki yerə bölünür (saf maddələr və qarışıqlar). Sabit fiziki xassələrə (ərimə, qaynama temperaturuna, sıxlığa və s.) malik olmayan maddələr qarışıqlara aiddir (bax mövzu 1 və 2).
3. Mənşəyinə görə maddələr qeyri-üzvi və üzvi maddələrə bölünür. Karbonun birləşmələrindən dəm qazı (CO), karbon qazı (CO2), karbonat turşusu (H2CO3), onun bütün duzları, məsələn, soda (Na2CO3), çay sodası (NaHCO3), əhəngdaşı (CaCO3) qeyri-üzvi birləşmələrə aiddir. Tərkibində yalnız karbon ©, hidrogen (H) və ya tərkibində karbon, hidrogen, oksigen olan birləşmələr və s. üzvi birləşmələrə aiddir.
Məsələn, metan qazı (CH4), etilen (C2H4), etil spirti (C2H5OH), sirkə turşusu (CH3COOH) və s. üzvi birləşmələrə aiddir.
4. Tərkibinə görə maddələr iki yerə bölünür: bəsit və mürəkkəb maddələr.
Maddələrin tərkibi eyni və yaxud müxtəlif element atomlarından ibarət ola bilər.
Eyni növ atomlardan əmələ gəlmiş maddələr bəsit maddələr adlanır.
Müxtəlif növ atomlardan əmələ gəlmiş maddələrə mürəkkəb maddələr deyilir.
Sizin tanıdığınız dəmir, mis, alüminium, civə, qalay, qurğuşun, qızıl, gümüş, kükürd, fosfor, yod, hidrogen, oksigen, almaz, qrafit və s. bəsit maddələrdir. Onlar bərk halda həm molekulyar (kükürd, ağ fosfor, yod və s.), həm də qeyri-molekulyar (dəmir, mis, almaz, qrafit və s.) quruluşa malik olduğundan müxtəlif xassəlidir. Xassələrinə görə bəsit maddələri 2 qrupa bölürlər: metallar və qeyri-metallar. Metallar adi şəraitdə bərk (civədən başqa) halda olur, elektrik cərəyanını və istiliyi yaxşı keçirir, plastik xassəlidir—döyülüb yastılana bilir. Fe, Cu, Al, Pb, Sn, Ag, Au, Zn, Na, К və s. elementlərin əmələ gətirdiyi bəsit maddələr metal xassəlidir. Onların adları elementlərin adı ilə eynidir. Qeyri-metallar isə əksinə, istiliyi pis keçirir, elektriki isə əsasən, keçirmirlər, onlar adi şəraitdə qaz, maye və bərk halda olur. Adi şəraitdə bərk halda olan qeyri-metallar (almaz, qrafit, yod, kükürd, fosfor və s.) kövrək xassəlidir — döyüldükdə asanlıqla qırılır. O, H, N, P, Cl, Br, J və s. qeyri-metallar eyniadlı müxtəlif aqreqat halında olan bəsit maddələr əmələ gətirir.
Bəsit maddələr kimyəvi elementlərin sərbəst halda mövcudluq formasıdır.
Eyni bir kimyəvi elementin bir neçə bəsit maddə əmələ gətirməsi hadisəsinə allotropiya, əmələ gəlmiş bəsit maddələrə isə həmin elementin allotropik şəkildəyişmələri deyilir.
Ona görə də bəsit maddələrin sayı (400-dən çox) kimyəvi elementlərin sayından çoxdur.

Allotropiya hadisəsi iki səbəbdən baş verir:
1. Molekulda atomların sayının müxtəlif olmasından: məsələn, oksigen (O2), ozon (O3).
2. Maddələrin kristal quruluşunun müxtəlif olmasından: məsələn, almaz, qrafit, karbin, fülleren.
Mürəkkəb maddələrin müxtəlif növ atomlardan təşkil olunduğunu sübut etmək üçün kimyəvi təcrübələrdən istifadə edirlər. Məsələn, suyun sabit elektrik cərəyanının təsiri ilə oksigen və hidrogen qazlarına parçalanmasını təcrübədə asanlıqla müşahidə etmək olar. Bunun üçün içərisində su olan aşağıdakı cihazı (Hofman cihazını) dövrəyə qoşaq .
Borudan (1) çıxan qazın oksigen olduğunu, «Həyat bilgisi» kursundan bildiyiniz kimi, közərmiş çöplə yoxlamaq olar. Hidrogen qazını yoxlamaq üçün borudan (2) çıxan qazı kiçik sınaq şüşəsinə yığıb spirt lampasının alovuna tuturuq. Bu zaman kiçik «pax» səsi eşidiləcəkdir. Hava qarışığı olmayan hidrogen isə sakit, rəngsiz alovla yanır.
Deməli, su iki müxtəlif element atomlarından—hidrogen (H) və oksigendən (O) ibarətdir, yəni o, mürəkkəb maddədir. Həmçinin bizim tanıdığımız xörək duzu (NaCl) Na və Cl, sönməmiş əhəng (CaO) Ca və O elementlərindən ibarət olub, mürəkkəb maddələrə aiddir. Mürəkkəb maddələrə başqa sözlə kimyəvi birləşmələr də deyilir.
Tərkibinə və xassələrinə görə mürəkkəb maddələrin 4 əsas qrupu var: oksidlər, əsaslar, turşular, duzlar.
Üzvi maddələr (şəkər, spirt, aseton, yağ, efir və s.) mürəkkəb maddələrin xüsusi bir qrupunu təşkil edir. Onlarla yuxarı siniflərdə tanış olacağıq.
Mürəkkəb maddələrə adi şəraitdə hər üç aqreqat halda (qaz, maye, bərk) rast gəlinir. Onlar müxtəlif xassəli və müxtəlif quruluşludur.
Bəsit və mürəkkəb maddələr barədə deyilənləri aşağıdakı sxemlə yekunlaşdıraq:
Kimyəvi elementlər təbiətdə eyni cür yayılmamışdır. Yer qabığının kütləcə təqribən yarısını oksigen (49,13%), ondan başqa silisium (25,7%), alüminium (7,3%), dəmir (4,7%), natrium (2,4%), kalium (2,4%), kalsium (3,25%), maqnezium (2,25%), hidrogen (1,0%), qalan elementlər isə ümumilikdə 1,87% təşkil edir.
Deməli, Yer qabığı, əsasən, 9 elementdən əmələ gəlmişdir, qalan elementlərin miqdarı çox azdır. Atmosferdə elementlərin paylanması fərqlidir. Yer qabığına yaxın təbəqələrdə həcmcə 78% azot, 21% oksigen, 1% digər qazlar olur.
Bəzi elementlərə təbiətdə sərbəst halda bəsit maddə şəklində rast gəlinir; məsələn, azot və oksigenə havada, kükürd, gümüş və qızıla yer qabığında rast gəlinir. Elementlərin əksəriyyəti təbiətdə mürəkkəb maddə — kimyəvi birləşmə şəklində yayılmışdır.
Təbiətdə və praktiki həyatda kimyəvi elementlərin əhəmiyyəti çox böyükdür. Məsələn, sənayedə 90-dan çox elementdən istifadə edilir.
Təqribən 25 element insanın həyat fəaliyyəti üçün çox vacibdir. Bu elementlərə biogen elementlər deyilir. Onlar da iki qrupa bölünür: makroelementlər (C, H, N, O, S, P, Ca, Mg, Na, K, Cl) və mikroelementlər (Cu, Mn, Fe, Zn, Mo, F, J, Se, Cr, Ni, V, Sn, As, Si). însana 1 gün ərzində makroelementlərdən 100 mq, mikroelementlərdən isə 10 mq lazımdır.
Elementlərin və onların birləşmələrinin kimyəvi xassələri haqqındakı biliklər insana yeni maddələr almağa, xəstəliklərlə mübarizə etməyə, təbiəti qorumağa kömək edir.
1. Molekulda atomların sayının müxtəlif olmasından: məsələn, oksigen (O2), ozon (O3).
2. Maddələrin kristal quruluşunun müxtəlif olmasından: məsələn, almaz, qrafit, karbin, fülleren.
Mürəkkəb maddələrin müxtəlif növ atomlardan təşkil olunduğunu sübut etmək üçün kimyəvi təcrübələrdən istifadə edirlər. Məsələn, suyun sabit elektrik cərəyanının təsiri ilə oksigen və hidrogen qazlarına parçalanmasını təcrübədə asanlıqla müşahidə etmək olar. Bunun üçün içərisində su olan aşağıdakı cihazı (Hofman cihazını) dövrəyə qoşaq .
Borudan (1) çıxan qazın oksigen olduğunu, «Həyat bilgisi» kursundan bildiyiniz kimi, közərmiş çöplə yoxlamaq olar. Hidrogen qazını yoxlamaq üçün borudan (2) çıxan qazı kiçik sınaq şüşəsinə yığıb spirt lampasının alovuna tuturuq. Bu zaman kiçik «pax» səsi eşidiləcəkdir. Hava qarışığı olmayan hidrogen isə sakit, rəngsiz alovla yanır.
Deməli, su iki müxtəlif element atomlarından—hidrogen (H) və oksigendən (O) ibarətdir, yəni o, mürəkkəb maddədir. Həmçinin bizim tanıdığımız xörək duzu (NaCl) Na və Cl, sönməmiş əhəng (CaO) Ca və O elementlərindən ibarət olub, mürəkkəb maddələrə aiddir. Mürəkkəb maddələrə başqa sözlə kimyəvi birləşmələr də deyilir.
Tərkibinə və xassələrinə görə mürəkkəb maddələrin 4 əsas qrupu var: oksidlər, əsaslar, turşular, duzlar.
Üzvi maddələr (şəkər, spirt, aseton, yağ, efir və s.) mürəkkəb maddələrin xüsusi bir qrupunu təşkil edir. Onlarla yuxarı siniflərdə tanış olacağıq.
Mürəkkəb maddələrə adi şəraitdə hər üç aqreqat halda (qaz, maye, bərk) rast gəlinir. Onlar müxtəlif xassəli və müxtəlif quruluşludur.
Bəsit və mürəkkəb maddələr barədə deyilənləri aşağıdakı sxemlə yekunlaşdıraq:

Kimyəvi elementlər təbiətdə eyni cür yayılmamışdır. Yer qabığının kütləcə təqribən yarısını oksigen (49,13%), ondan başqa silisium (25,7%), alüminium (7,3%), dəmir (4,7%), natrium (2,4%), kalium (2,4%), kalsium (3,25%), maqnezium (2,25%), hidrogen (1,0%), qalan elementlər isə ümumilikdə 1,87% təşkil edir.
Deməli, Yer qabığı, əsasən, 9 elementdən əmələ gəlmişdir, qalan elementlərin miqdarı çox azdır. Atmosferdə elementlərin paylanması fərqlidir. Yer qabığına yaxın təbəqələrdə həcmcə 78% azot, 21% oksigen, 1% digər qazlar olur.
Bəzi elementlərə təbiətdə sərbəst halda bəsit maddə şəklində rast gəlinir; məsələn, azot və oksigenə havada, kükürd, gümüş və qızıla yer qabığında rast gəlinir. Elementlərin əksəriyyəti təbiətdə mürəkkəb maddə — kimyəvi birləşmə şəklində yayılmışdır.
Təbiətdə və praktiki həyatda kimyəvi elementlərin əhəmiyyəti çox böyükdür. Məsələn, sənayedə 90-dan çox elementdən istifadə edilir.
Təqribən 25 element insanın həyat fəaliyyəti üçün çox vacibdir. Bu elementlərə biogen elementlər deyilir. Onlar da iki qrupa bölünür: makroelementlər (C, H, N, O, S, P, Ca, Mg, Na, K, Cl) və mikroelementlər (Cu, Mn, Fe, Zn, Mo, F, J, Se, Cr, Ni, V, Sn, As, Si). însana 1 gün ərzində makroelementlərdən 100 mq, mikroelementlərdən isə 10 mq lazımdır.
Elementlərin və onların birləşmələrinin kimyəvi xassələri haqqındakı biliklər insana yeni maddələr almağa, xəstəliklərlə mübarizə etməyə, təbiəti qorumağa kömək edir.
Müəllif: Nasim Abışov,Günay Quliyeva,Vəli Əliyev,Vaqif Abbasov,Mütəllim Abbasov
Mənbə: Ümumtəhsil məktəblərinin 7-ci sinfi üçün Kimya fənni üzrə Dərslik
0 şərh