Kimyəvi formullar. Tərkibin sabitliyi qanunu. Valentlik
Maddə tərkibinin kimyəvi işarələr və indekslər vasitəsilə şərti yazılışı kimyəvi formul adlanır.
Elementin işarəsinin sağ tərəfində aşağıda yazılan və atomların sayını göstərən ədədə indeks deyilir.
12-ci şəkildə verilmiş molekül modellərinə əsasən hidrogen və oksigen qazlarının və suyun kimyəvi formullarını yazsaq: H2, O2, H2O alarıq. Həmin formullara görə deyə bilərik ki, hidrogen və oksigen qazlarının molekülü 2 hidrogen və 2 oksigen atomlarından; suyun molekülü 2 hidrogen və 1 oksigen atomlarından ibarətdir. Deməli, molekulyar quruluşlu maddələrin kimyəvi formulları onların keyfiyyətcə və kəmiyyətcə tərkibini göstərir.
Maddələrin tərkibini müxtəlif fiziki-kimyəvi üsullarla, kimyəvi təcrübələrin nəticələrini təhlil etməklə müəyyənləşdirirlər. Məsələn, suyun sabit elektrik cərəyanının təsiri ilə parçalanmasından alınan hidrogen qazının həcminin oksigen qazının həcmindən iki dəfə artıq olduğu müşahidə edilir. Bu həcm nisbətini kütlə nisbətinə çevirdikdə m(H):m(O)=1:8 olduğu müəyyənləşir. Yəni 9 q su parçalandıqda həmişə 1 q hidrogen və 8 q oksigen alındığı məlum olur. Həmin ədədləri elementlərin nisbi atom kütlələri ilə müqayisə etdikdə su molekülünün iki hidrogen və bir oksigen atomundan ibarət olması nəticəsinə gəlinir.
COZEF LUİ PRUST (1754-1826)
Fransız kimyaçısı. 1799-cu ildən 1806-cı ilə qədər olan dövrdə müxtəlif oksidlərin, sulfidlərin və başqa maddələrin tərkibini tədqiq etmişdir. Nəticədə kimyəvi birləşmələrin tərkibinin sabitliyi qanununu kəşf etmişdir.
Suyun, eləcə də başqa birləşmələrin tərkibi alınma üsulundan və tapılma yerindən asılı olmayaraq, həmişə sabit olur. Bu qanun 1799-cu ildə fransız kimyaçısı C.L.Prust tərəfindən kəşf edilmişdir. Maddə tərkibinin sabitliyi qanunu hazırda belə ifadə olunur: Alınma üsulundan asılı olmayaraq, molekulyar quruluşlu kimyəvi birləşmələrin tərkibi və xassələri həmişə sabit olur.
Molekulyar quruluşlu maddələrin tərkibi və xassələrinin dəyişməzliyi barədə olan bu qanun kimyanın əsas qanunlarından biridir. Qeyri-molekulyar quruluşlu bir çox birləşmələr üçün tərkibin sabitliyi qanunu ödənilmir.
Bildiyimiz kimi, maddələrin hamısı molekulyar quruluşlu deyil. Onların böyük bir qrupu atomlardan və ionlardan təşkil olunur. Bəs bu maddələrin kimyəvi formulları necə tərtib olunur?
Qeyri-molekulyar quruluşlu maddələrin kimyəvi formulu birləşmədəki element hissəciklərinin (atom və ya ionların) say nisbətinə əsasən tərtib edilir. Bu nisbətləri bilmək üçün qeyri-molekulyar quruluşlu maddənin kristalında bir element hissəciyinin başqa elementin neçə hissəciyi ilə əhatə olunduğu (birləşdiyi) müəyyənləşdirilməlidir. Maddənin kristal quruluşunun fiziki üsullarla tədqiqi belə məlumatlar əldə etməyə imkan verir. Bu cür tədqiqatların nəticəsində məlum olmuşdur ki, kvarsda silisium və oksigen atomlarının say nisbəti 1:2-dir. Deməli, onun formulu SiO2-dir. Alüminium-xloriddə isə alüminium və xlor ionlarının say nisbəti 1:3-dür. Deməli, onun formulu AlCl3 olmalıdır.
Kimyəvi elementlərin 3-cü cədvəldə göstərilən qısa adlarından istifadə edərək, formulları oxumaq olar:
CO2 — se — o — 2;
H2O — haş — 2 — o;
CH4 — se — haş — 4;
SiO2 — silisium — o — 2;
AlCl3 — alüminium — xlor — 3;
P2O5 — pe — 2 — o — 5 və i.a.
(Kimyəvi formulların beynəlxalq oxunuş qaydası ilə sonralar tanış olacaqsınız).
 Kimyəvi elementlərin valentliyi. Valentliyə görə formulların tərtibi. Məlumdur ki, maddələrin formulları kimyəvi təcrübələr əsasında çıxarılır. Bir neçə elementin təcrübə ilə alınmış hidrogenli birləşmələrinin formullarını nəzərdən keçirək:
Kimyəvi elementlərin valentliyi. Valentliyə görə formulların tərtibi. Məlumdur ki, maddələrin formulları kimyəvi təcrübələr əsasında çıxarılır. Bir neçə elementin təcrübə ilə alınmış hidrogenli birləşmələrinin formullarını nəzərdən keçirək:
HCl, H2O, NH3, CH4
Bu formullardan görünür ki, xlor atomu 1, oksigen atomu 2, azot atomu 3, karbon atomu 4 hidrogen atomu ilə birləşə bilir. Deməli, elementlərin özünə hidrogen atomlarını birləşdirmək qabiliyyəti müxtəlifdir.
Kimyəvi element atomlarının özünə müəyyən sayda başqa element atomlarını birləşdirmək qabiliyyətinə valentlik deyilir.
Valentlik anlayışı ilk dəfə 1852-ci ildə ingilis alimi E.Frankland tərəfindən elmə daxil edilmişdir.
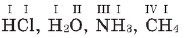 Göstərilənlərə əsasən deyirik: hidrogenə görə xlorun valentliyi bir, oksigenin valentliyi iki, azotun valentliyi üç, karbonun valentliyi dörddür.
Göstərilənlərə əsasən deyirik: hidrogenə görə xlorun valentliyi bir, oksigenin valentliyi iki, azotun valentliyi üç, karbonun valentliyi dörddür.

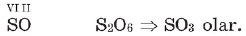
Elementin işarəsinin sağ tərəfində aşağıda yazılan və atomların sayını göstərən ədədə indeks deyilir.
12-ci şəkildə verilmiş molekül modellərinə əsasən hidrogen və oksigen qazlarının və suyun kimyəvi formullarını yazsaq: H2, O2, H2O alarıq. Həmin formullara görə deyə bilərik ki, hidrogen və oksigen qazlarının molekülü 2 hidrogen və 2 oksigen atomlarından; suyun molekülü 2 hidrogen və 1 oksigen atomlarından ibarətdir. Deməli, molekulyar quruluşlu maddələrin kimyəvi formulları onların keyfiyyətcə və kəmiyyətcə tərkibini göstərir.
Maddələrin tərkibini müxtəlif fiziki-kimyəvi üsullarla, kimyəvi təcrübələrin nəticələrini təhlil etməklə müəyyənləşdirirlər. Məsələn, suyun sabit elektrik cərəyanının təsiri ilə parçalanmasından alınan hidrogen qazının həcminin oksigen qazının həcmindən iki dəfə artıq olduğu müşahidə edilir. Bu həcm nisbətini kütlə nisbətinə çevirdikdə m(H):m(O)=1:8 olduğu müəyyənləşir. Yəni 9 q su parçalandıqda həmişə 1 q hidrogen və 8 q oksigen alındığı məlum olur. Həmin ədədləri elementlərin nisbi atom kütlələri ilə müqayisə etdikdə su molekülünün iki hidrogen və bir oksigen atomundan ibarət olması nəticəsinə gəlinir.
COZEF LUİ PRUST (1754-1826)
Fransız kimyaçısı. 1799-cu ildən 1806-cı ilə qədər olan dövrdə müxtəlif oksidlərin, sulfidlərin və başqa maddələrin tərkibini tədqiq etmişdir. Nəticədə kimyəvi birləşmələrin tərkibinin sabitliyi qanununu kəşf etmişdir.
Suyun, eləcə də başqa birləşmələrin tərkibi alınma üsulundan və tapılma yerindən asılı olmayaraq, həmişə sabit olur. Bu qanun 1799-cu ildə fransız kimyaçısı C.L.Prust tərəfindən kəşf edilmişdir. Maddə tərkibinin sabitliyi qanunu hazırda belə ifadə olunur: Alınma üsulundan asılı olmayaraq, molekulyar quruluşlu kimyəvi birləşmələrin tərkibi və xassələri həmişə sabit olur.
Molekulyar quruluşlu maddələrin tərkibi və xassələrinin dəyişməzliyi barədə olan bu qanun kimyanın əsas qanunlarından biridir. Qeyri-molekulyar quruluşlu bir çox birləşmələr üçün tərkibin sabitliyi qanunu ödənilmir.
Bildiyimiz kimi, maddələrin hamısı molekulyar quruluşlu deyil. Onların böyük bir qrupu atomlardan və ionlardan təşkil olunur. Bəs bu maddələrin kimyəvi formulları necə tərtib olunur?
Qeyri-molekulyar quruluşlu maddələrin kimyəvi formulu birləşmədəki element hissəciklərinin (atom və ya ionların) say nisbətinə əsasən tərtib edilir. Bu nisbətləri bilmək üçün qeyri-molekulyar quruluşlu maddənin kristalında bir element hissəciyinin başqa elementin neçə hissəciyi ilə əhatə olunduğu (birləşdiyi) müəyyənləşdirilməlidir. Maddənin kristal quruluşunun fiziki üsullarla tədqiqi belə məlumatlar əldə etməyə imkan verir. Bu cür tədqiqatların nəticəsində məlum olmuşdur ki, kvarsda silisium və oksigen atomlarının say nisbəti 1:2-dir. Deməli, onun formulu SiO2-dir. Alüminium-xloriddə isə alüminium və xlor ionlarının say nisbəti 1:3-dür. Deməli, onun formulu AlCl3 olmalıdır.
Kimyəvi elementlərin 3-cü cədvəldə göstərilən qısa adlarından istifadə edərək, formulları oxumaq olar:
CO2 — se — o — 2;
H2O — haş — 2 — o;
CH4 — se — haş — 4;
SiO2 — silisium — o — 2;
AlCl3 — alüminium — xlor — 3;
P2O5 — pe — 2 — o — 5 və i.a.
(Kimyəvi formulların beynəlxalq oxunuş qaydası ilə sonralar tanış olacaqsınız).
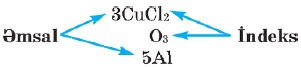
Kimyəvi formulların və kimyəvi işarələrin qarşısında yazılan ədəd əmsal adlanır. Elementin işarəsinin sağ tərəfində aşağıda yazılan ədəd indeks adlanır.

HCl, H2O, NH3, CH4
Bu formullardan görünür ki, xlor atomu 1, oksigen atomu 2, azot atomu 3, karbon atomu 4 hidrogen atomu ilə birləşə bilir. Deməli, elementlərin özünə hidrogen atomlarını birləşdirmək qabiliyyəti müxtəlifdir.
Kimyəvi element atomlarının özünə müəyyən sayda başqa element atomlarını birləşdirmək qabiliyyətinə valentlik deyilir.
Valentlik anlayışı ilk dəfə 1852-ci ildə ingilis alimi E.Frankland tərəfindən elmə daxil edilmişdir.
Hidrogenin valentliyi vahid qəbul olunaraq, o biri elementlərin valentliyi onunla müqayisə edilir. Valentliyi roma rəqəmi ilə göstərirlər. Məsələn, aşağıdakı birləşmələrdə elementlərin valentliyini onların işarələrinin üstündə göstərək:
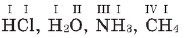
Oksigenin valentliyinin II olduğunu bilərək, başqa elementlərin oksigenli birləşmələrindəki valentliyini də hesablama yolu ilə təyin etmək olar. Bunun üçün oksigen atomunun kimyəvi formulda verilmiş indeksini valentliyinə vurub o biri element atomunun indeksinə bölmək lazımdır. Məsələn, AI2O3 birləşməsində alüminium atomunun oksigenə görə valentliyini təyin edək.

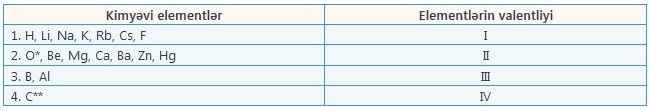
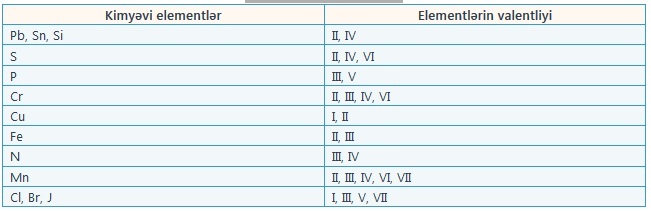
Bir qrup kimyəvi elementlərin valentlikləri onların bütün kimyəvi birləşmələrində dəyişmir, yəni həmişə eyni rəqəmlə göstərilir. Onlara sabit valentli elementlər deyilir.
EDUARD FRANKLEND (1825-1899)
İngilis kimyaçısı. 1852-ci ildə atomları bir-birinə birləşdirici qüvvə haqqında anlayışı elmə daxil etmişdir. Atomların bu xassələrini sonralar valentlik adlandırmışlar.
İngilis kimyaçısı. 1852-ci ildə atomları bir-birinə birləşdirici qüvvə haqqında anlayışı elmə daxil etmişdir. Atomların bu xassələrini sonralar valentlik adlandırmışlar.

Başqa elementlər qrupu isə müxtəlif kimyəvi birləşmələrdə müxtəlif valentliyə malik olur. Onlara dəyişkən valentli elementlər deyilir.
* Oksigen CO və Н3О+ -da III valentlidir.
** Karbon CO-da III valentlidir.
* Oksigen CO və Н3О+ -da III valentlidir.
** Karbon CO-da III valentlidir.

Kimyəvi elementin valentliyini bilməklə onların əmələ gətirdiyi binar (ikielementli) birləşmənin formulunu asanlıqla tərtib etmək olar. Bunun üçün elementlərin işarələrini yazıb, üstündə valentliklərini göstərirlər. Sonra həmin valentliyi göstərən ədədlərin ən kiçik ortaq bölünənini (ƏKOB) müəyyənləşdirib, onu valentliklərin hər birinə bölərək indeksləri tapırlar.
Məsələn, VII valentli manqan elementinin oksigenlə əmələ gətirdiyi birləşmənin formulunu tərtib edək:
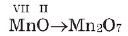
Valentliklərə görə formul tərtib edildikdə alınan indekslər ən kiçik tam ədədlərə qədər ixtisar olunursa, onda bu əməliyyatı aparıb maddənin sadə formulunu müəyyən etmək olar.
Məsələn, VII valentli manqan elementinin oksigenlə əmələ gətirdiyi birləşmənin formulunu tərtib edək:
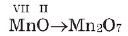
Valentliklərə görə formul tərtib edildikdə alınan indekslər ən kiçik tam ədədlərə qədər ixtisar olunursa, onda bu əməliyyatı aparıb maddənin sadə formulunu müəyyən etmək olar.
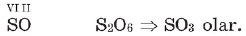
Müəllif: Nasim Abışov,Günay Quliyeva,Vəli Əliyev,Vaqif Abbasov,Mütəllim Abbasov
Mənbə: Ümumtəhsil məktəblərinin 7-ci sinfi üçün Kimya fənni üzrə Dərslik
0 şərh